Predict life on a chip
PredictableReliableReproducible
Perform realistic, controlled, and reproducible tests in a 3D human and dynamic environment in vitro
MIVO® is the only organ on chip technology that combines clinically relevant tissue size with independent millifluidic environments, where the fluid flow is fully controlled anytime.
advanced organ-on-chip
MIVO® technology to Recapitulate Human Biology
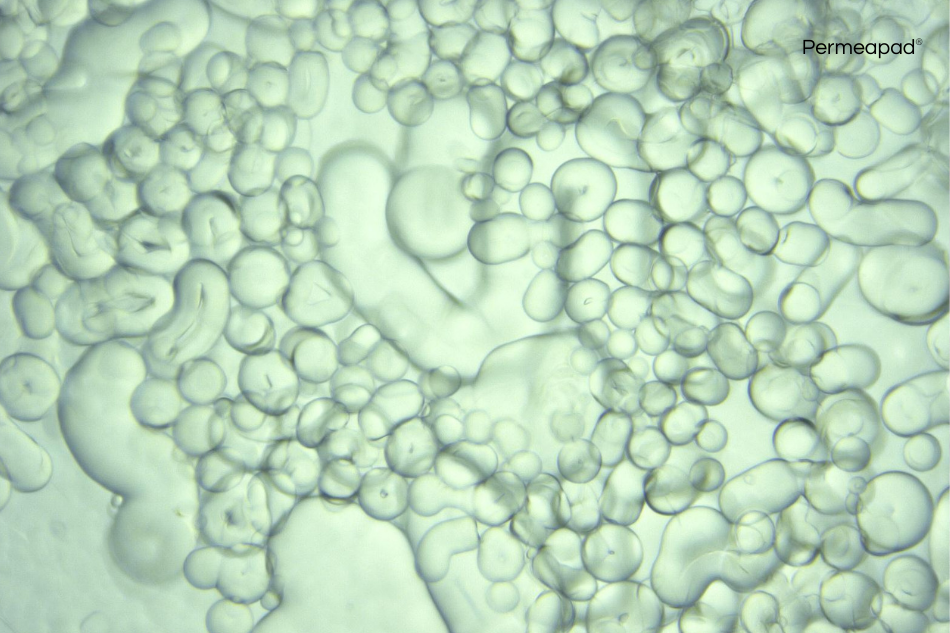
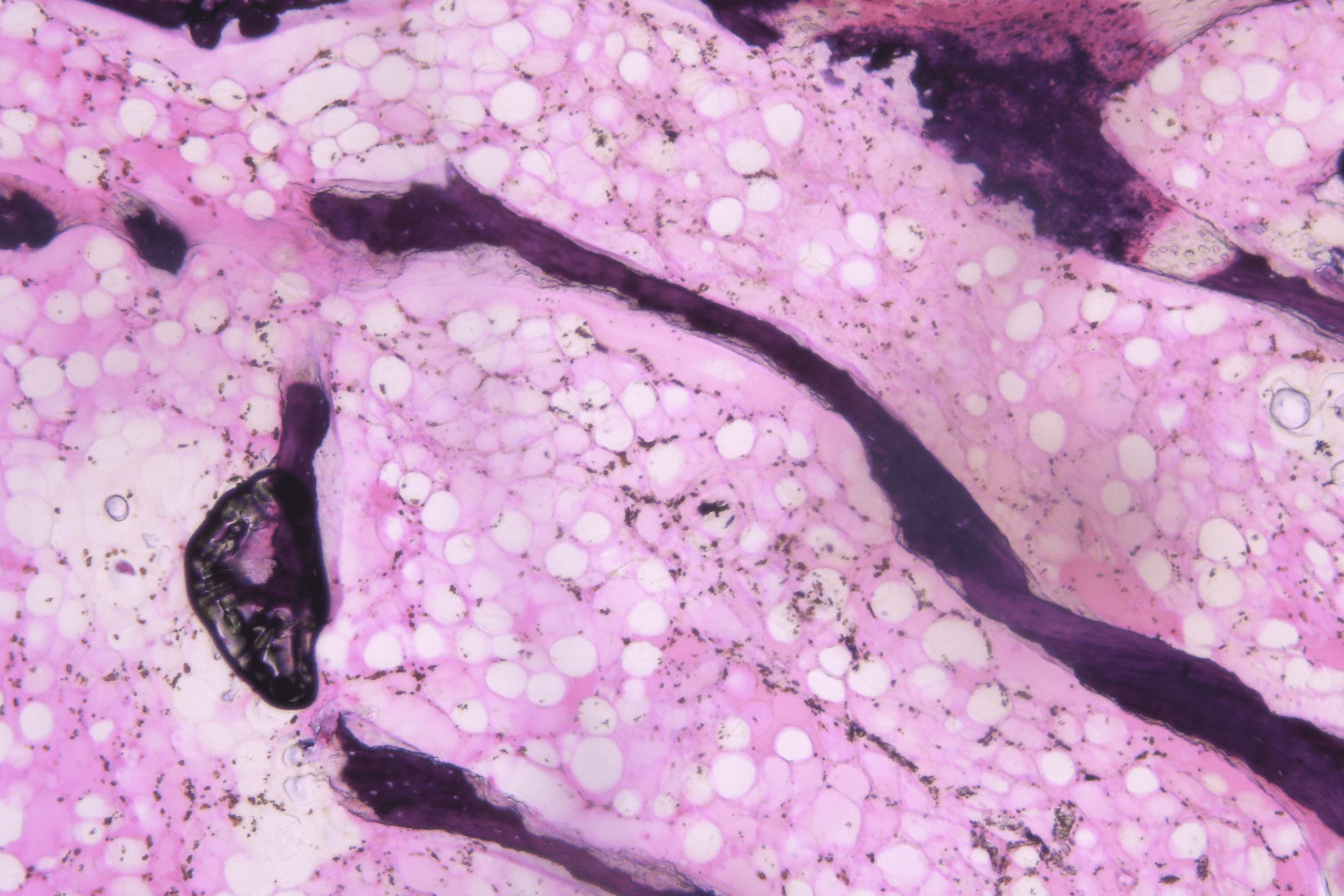
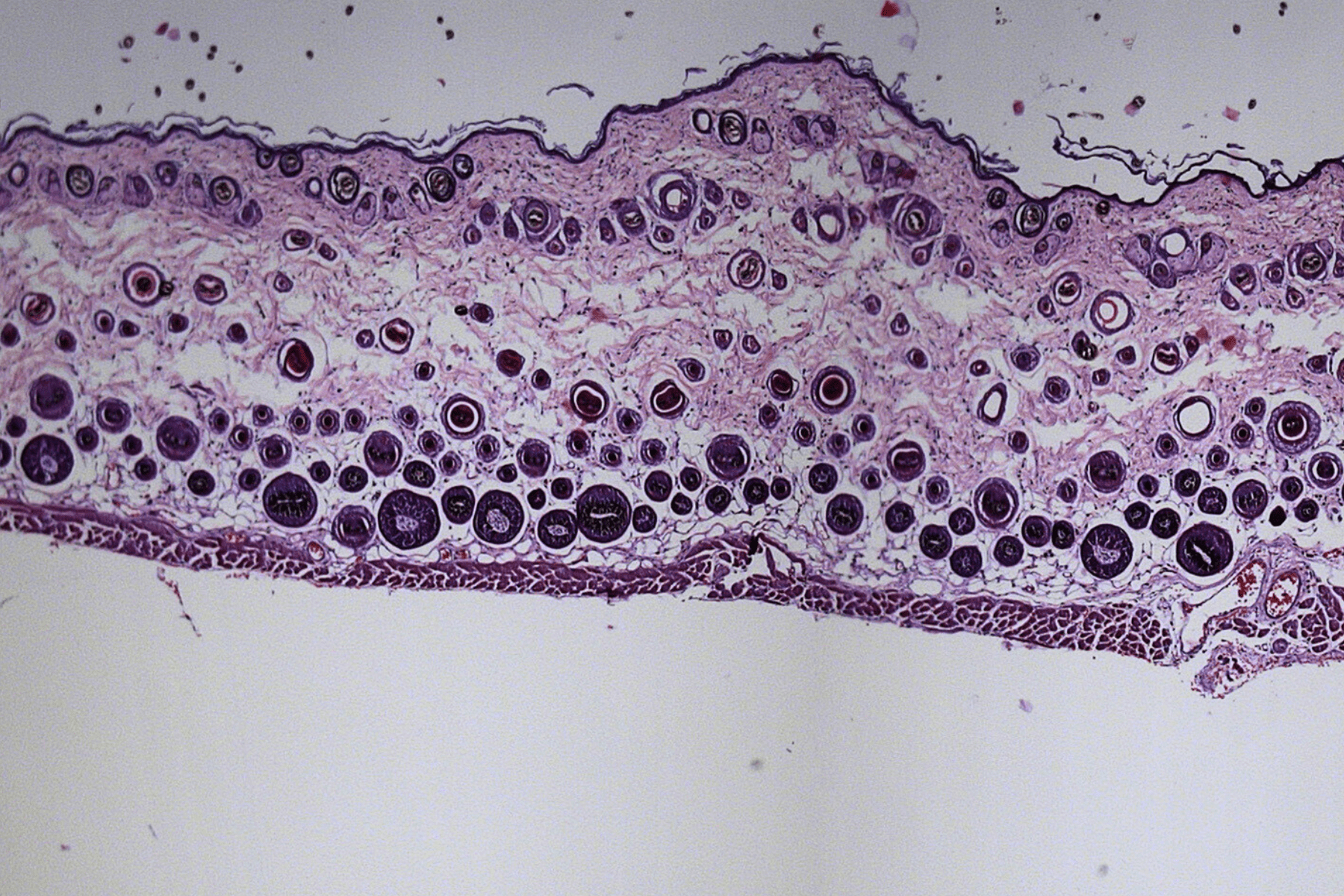
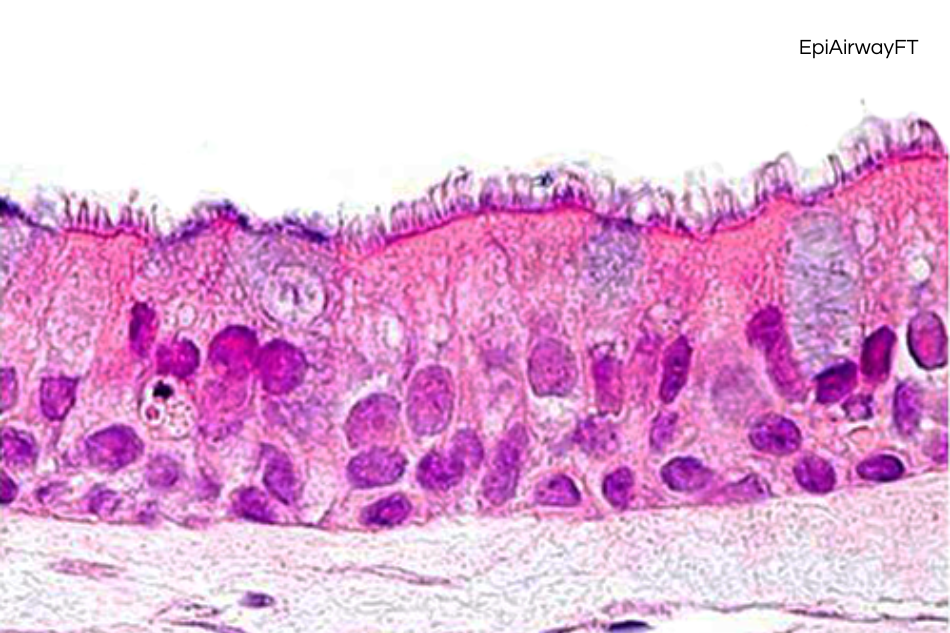
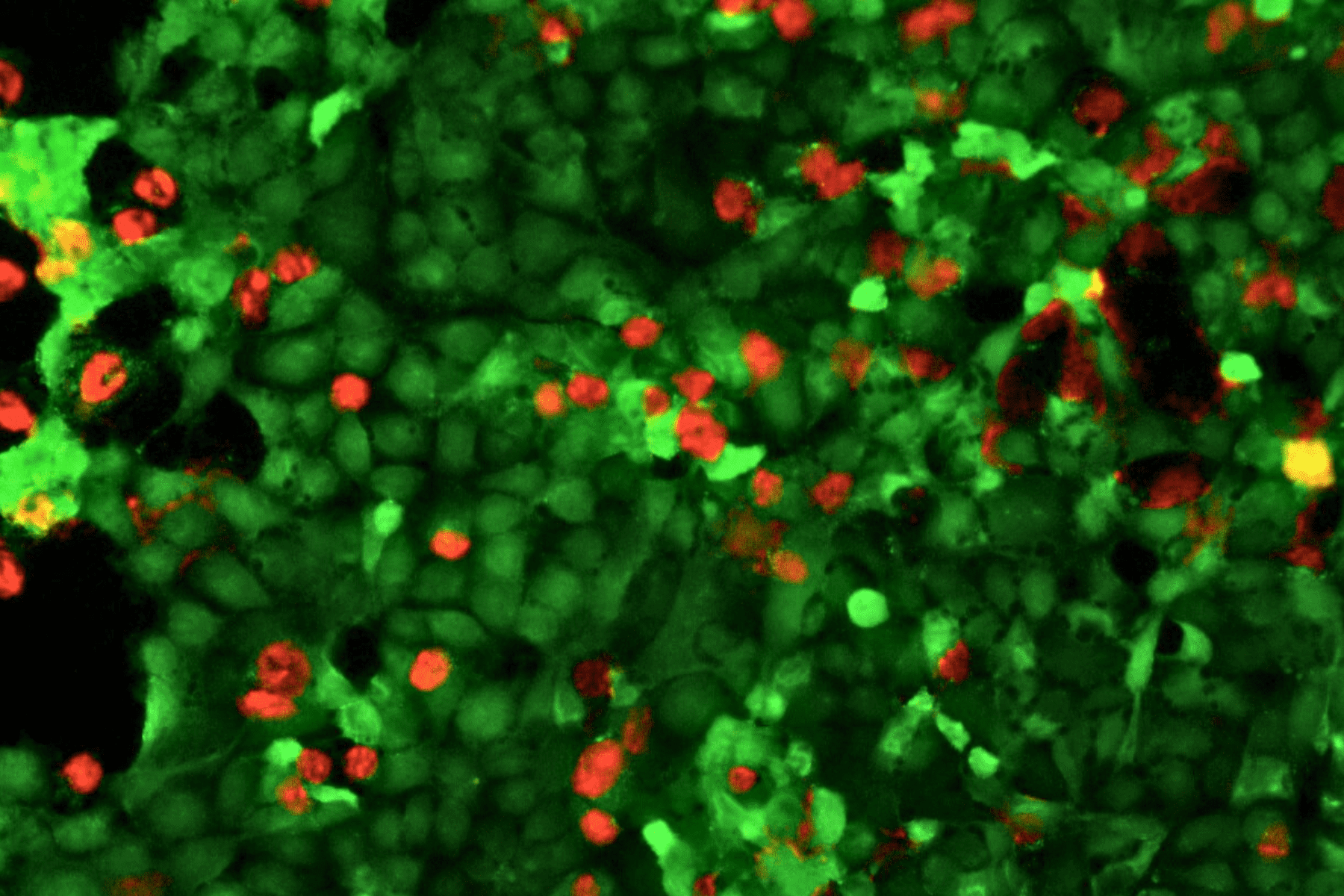
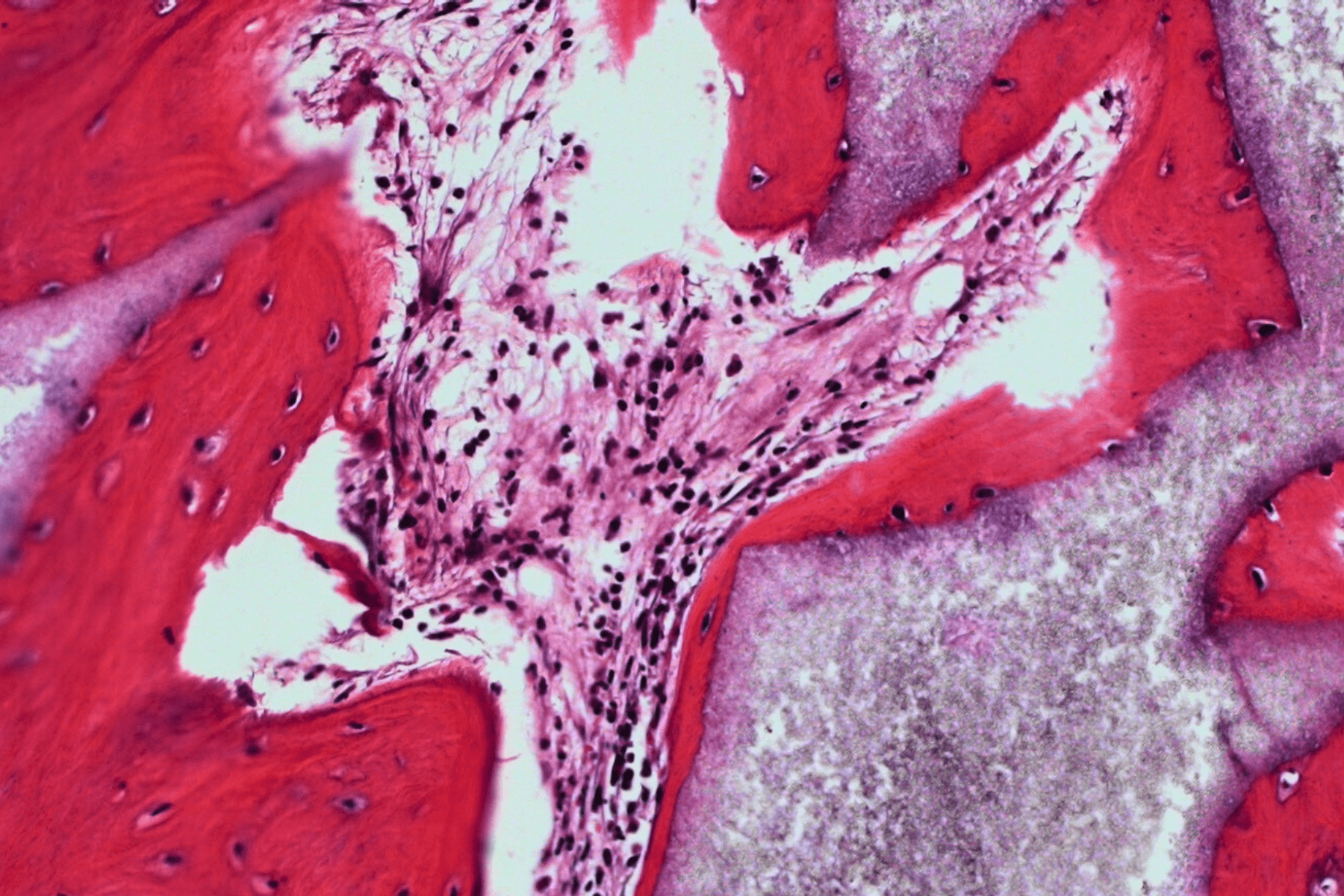
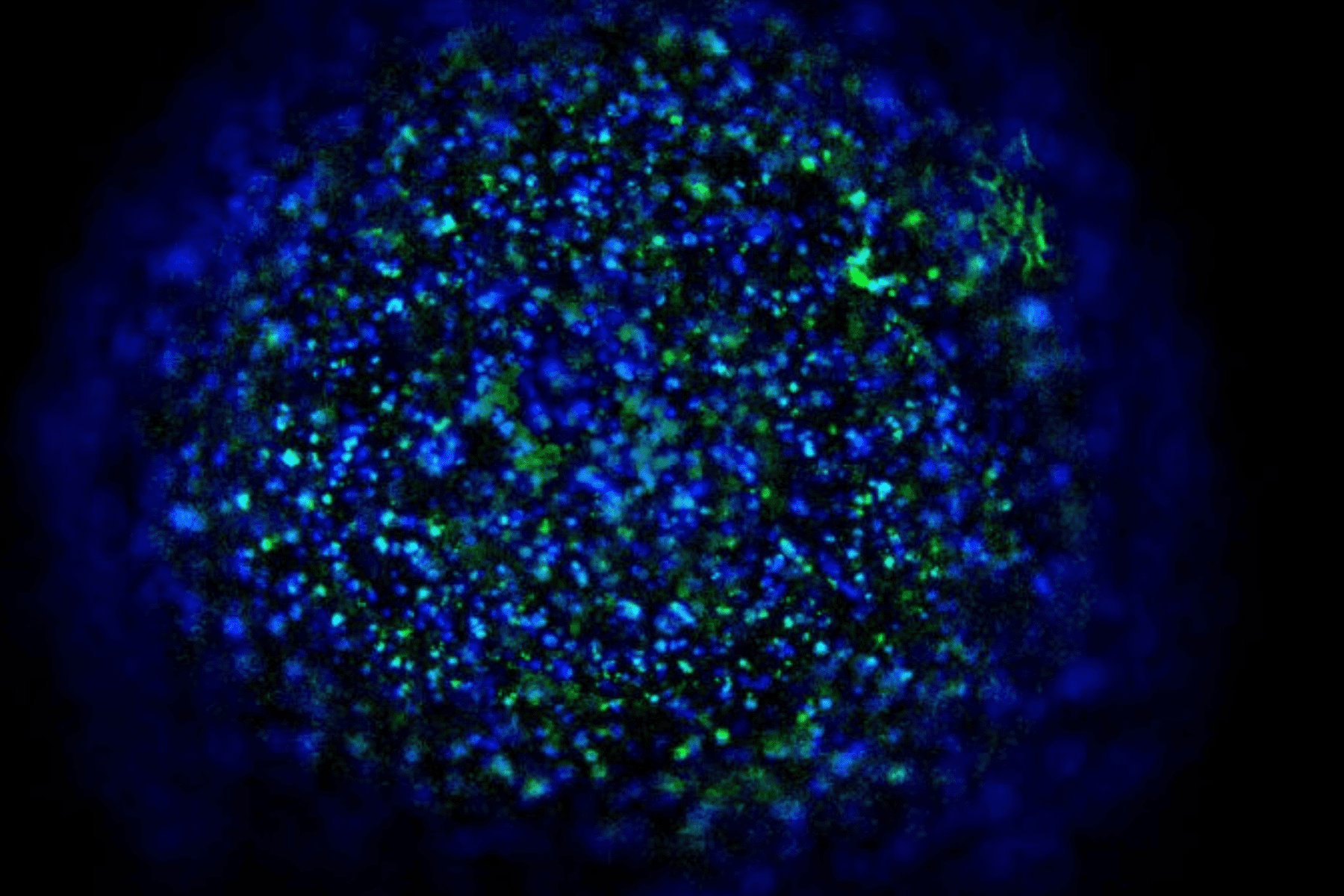
3D humanized tissue models
3D cell cultures provide a more accurate model of cells behaviour and interactions, making them crucial for developing personalized therapies and accelerating new drugs discovery.
in a controlled dynamic environment
Fluid flow is a critical factor affecting cells’ behaviour, diffusion of soluble factors and organ-organ interplay, behind many complex human diseases.
choose your organ on chip
Organ-on-Chip Models
Our range of Organs-on-chip models is designed to provide researchers with a more accurate, predictive, and physiologically relevant platform for their research needs. Choose from our available models to advance your research today.
Trusted by leading institutions
“ Enlightening training sessions with great scientific interactions with the R&D team ”
⸺ Dr. Filippo Acconcia
APPLICATION AREAS
Applications
Area of impact
A deeper understanding of human biology and its complexities is now possible.
Whether in disease modeling, regenerative medicine, or drug discovery, Explore the research areas where MIVO® technology can lead to more successful and impactful results.
APPLICATION AREAS
Applications
Publications
Insights, Results &Validations
Leverage your assay reading our scientists’ results in their publications. Get ready to reach the top of research with MIVO technology.
Find out the benefits of a millifluidic device as well as the increase in reliability due to 3D tissue culture. Check all resources to get into the organ on chip world.